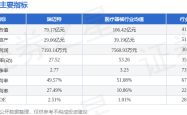
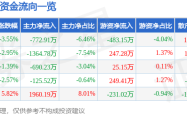
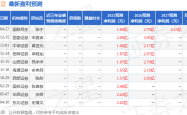
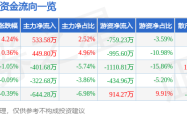
信达生物伊匹木单抗联合信迪利单抗获优先审评:肿瘤免疫治疗领域的又一突破?
信达生物(01801.HK)近日宣布,其自主研发的伊匹木单抗注射液联合信迪利单抗用于治疗可切除的微卫星高度不稳定型(MSI-H)或错配修复缺陷型(dMMR)结肠癌的NDA已获得国家药监局(NMPA)受理,并纳入优先审评程序。这一消息无疑为信达生物,乃至整个中国生物医药行业注入了一针强心剂。
伊匹木单抗是国内首个递交NDA的自主研发CTLA-4单抗,这标志着中国在肿瘤免疫治疗领域取得了显著进展。其联合信迪利单抗的疗法,更是为MSI-H/dMMR结肠癌患者带来了新的希望。此前,信迪利单抗已在多个癌种展现出优秀的疗效,此次联合伊匹木单抗,强强联手,有望进一步提升治疗效果,拓宽适应症范围。
此次NDA获受理并纳入优先审评,是基于一项名为NeoShot(NCT05890742)的III期临床研究结果。该研究在中国进行,是一项随机、对照、多中心研究,旨在评估伊匹木单抗联合信迪利单抗新辅助治疗可切除MSI-H/dMMR结肠癌的有效性和安全性。研究的主要终点为病理完全缓解率(pCR)和无事件生存期(EFS)。值得关注的是,NeoShot研究的中期分析结果已达到预设的主要研究终点,这为NDA的成功申报奠定了坚实的基础。独立数据监查委员会(IDMC)的评估结果也进一步印证了该疗法的可行性和安全性。
虽然具体的临床数据尚未公开发表,但根据信达生物以往的表现和此次获批优先审评的利好消息,我们可以推测该疗法在pCR和EFS方面取得了显著的改善。未来,这项研究结果将在学术会议或期刊上发表,届时我们将能看到更详细的数据和分析。
从更宏观的角度来看,信达生物此举不仅提升了自身在肿瘤免疫治疗领域的竞争力,也推动了中国创新药的发展。随着越来越多自主研发的创新药物获得批准上市,中国的生物医药行业将更加充满活力,为患者提供更多更好的治疗选择。
当然,我们也要保持理性看待。最终的市场表现还取决于多方面因素,例如定价策略、市场推广、医保准入等。但这并不影响我们对信达生物此次重大突破的肯定与期待。伊匹木单抗联合信迪利单抗的成功上市,将有望改变MSI-H/dMMR结肠癌的治疗格局,为患者带来福音,并为中国创新药研发树立新的标杆。
1.本站遵循行业规范,任何转载的稿件都会明确标注作者和来源;2.本站的原创文章,请转载时务必注明文章作者和来源,不尊重原创的行为我们将追究责任;3.作者投稿可能会经我们编辑修改或补充。